色站 精神疾病中, 神经科学的作用被高估了吗?

一、序论色站
为奠定本综述的基础,开端需要明确其规模,清醒“精神疾病”(mentalillness)这一术语的含义。“精神疾病”过火相关术语“精神健康”(mentalhealth)常被使用,但界说却不够明晰。在神经科学商量的配景下,东谈主们格外关爱清醒领会、行径和心理懒散在健康与疾病状态下的神经生物学基础。
这里,咱们将聚焦于与疾病相关的懒散。但对于精神疾病,尤其是心绪和惊险艰难来说,健康与疾病的界限显得尤为恶浊,不同疾病之间的界限更是难以分明。在骨子操作时,精神科大夫和相关东谈主士以较为平方的圭臬差异健康与疾病,即精神健康症状必须“引起临床上权臣的不幸或在社会、奇迹或其他垂死功能领域变成毁伤”[1]。个体的疾病分类,更多基于其症状弘扬,而非实验室检测或病因学的发现。
对于商量东谈主类受试者的神经科学家来说,这种分类式样并不适用于总共领域,尤其是在识别与疾病相关的一般和特定疾病的端庄关联方面。因此,近来兴起了一种趋势,着眼于特定功能领域的神经科学商量——举例接管好意思国国度心理健康商量所提议的商量领域圭臬(RDoC)框架[2]这么的分类系统,来陈述可能在疾病中受扰的神经生物学通路。
这些设施尤其适用于神经科学,因为比拟商量多方面且异质的疾病,跨物种商量功能领域要愈加径直。因此,本综述将较少关爱具体疾病的模子,安然探讨奈何通过对功能领域清醒的进展带来更好的顾问设施。
在这一配景下,清醒神经科学的界说也至关垂死。诚然精神疾病的症状弘扬在大脑中,但其他器官系统也在其中浮现了垂死作用。举例,免疫系统和胃肠谈系统被合计与精神疾病风险相关,它们通过激素、神经递质,以致可能通过细胞将信号传递至大脑,至极是在神经发育时间,当要津的神经回路正在诞生和修改时[3~6]。
体液应激激素(Humoralstresshormones)看成核心神经系统与外周器官谀媚的标志,也径直或曲折影响大脑功能,对与精神疾病相关的功能领域产生深入影响[7]。尽管这些领域的商量在精神疾病的清醒和诊疗中起到了垂死作用,但本综述将主要聚焦于基于大脑本人的商量进展。
在清醒精神疾病源于大脑,且精神疾病的神经科学包括商量行径、领会和心理功能领域的大脑基础这一前提下,本综述将开端商榷往日的神经科学发现奈何促成了现时可用的精神疾病临床设施。接下来,咱们将重心商榷比年来遗传学、分子神经科学、神经回路以及操办设施领域的权臣进展。在这些领域中,技艺和观念上的创新极地面增强了咱们对与精神疾病相关的功能领域神经生物学的清醒。咱们将探讨每个领域的最新进展,并分析这些进展滚动为新的临床设施的可能。
二、往日的前瞻性:神经科学对现存疗法的孝顺
在商榷神经科学对现时精神疾病诊疗的孝顺时,咱们不得不承认一个被普通援用的不雅点:很多紧要发现源于就怕。事实上,正如Hyman所指出的[8],很多药物被引入精神科“有十分进度上的就怕性”。举例,锂其实早在19世纪末就依然用于诊疗心绪艰难,远早于20世纪40年代的再行发现[9]。但开端的尝试和之后考证其诊疗躁狂症疗效的商量,都是基于作假的病理生理学表面[10]。尽管这些药物疗法的发现充满就怕性,神经科学仍在其中演出了垂死的扶植脚色。
氯丙嗪,看成首个抗神经病药物,是从早已被合计具有安宁作用的苯噻嗪类抗组胺药发展而来的[9]。开端,氯丙嗪的合成和商量是为了看成止痛药的扶植药物;在这一用途上失败后,它被尝试用于安宁躁狂型神经病患者,收尾发现它不错减弱神经病症状[11]。
相同,第一个抗抑郁药丙咪嗪亦然从抗组胺药物发展而来;受氯丙嗪效果的启发,它也被用于神经病患者。诚然它未能缓解神经病症状,但其效果教导它可能对减弱抑郁症状有用。进一步对非神经病性抑郁症患者的测试证实了其诊疗后劲[12]。因此,这两种药物的发现都是基于对组胺受体作用的清醒,尽管它们的骨子诊疗后劲与那时的神经科学预期有所不同。
神经科学无疑在心理药理学领域的初步探索基础上,为扩大诊疗采用范围浮现了垂死作用,这些初步探索大多是就怕发现的收尾。举例,继氯丙嗪的发现和其他苯噻嗪类药物的发展之后,结合啮齿动物的行径商量和受体结合实验标明,抗神经病药物的疗效与D2受体的结合计算(见图1)[13,14]。这一发现为进一步开发更多抗神经病药物铺平了谈路。
类似的发现还有很多:通过再汲取泵撤废神经递质的机制启发了如今使用的各式新式抗抑郁药物。最有名的是,诺贝尔奖取得者JuliusAxelrod和他的共事们讲授,丙咪嗪和其他精神药物不错扼制去甲肾上腺素的再汲取[15]。
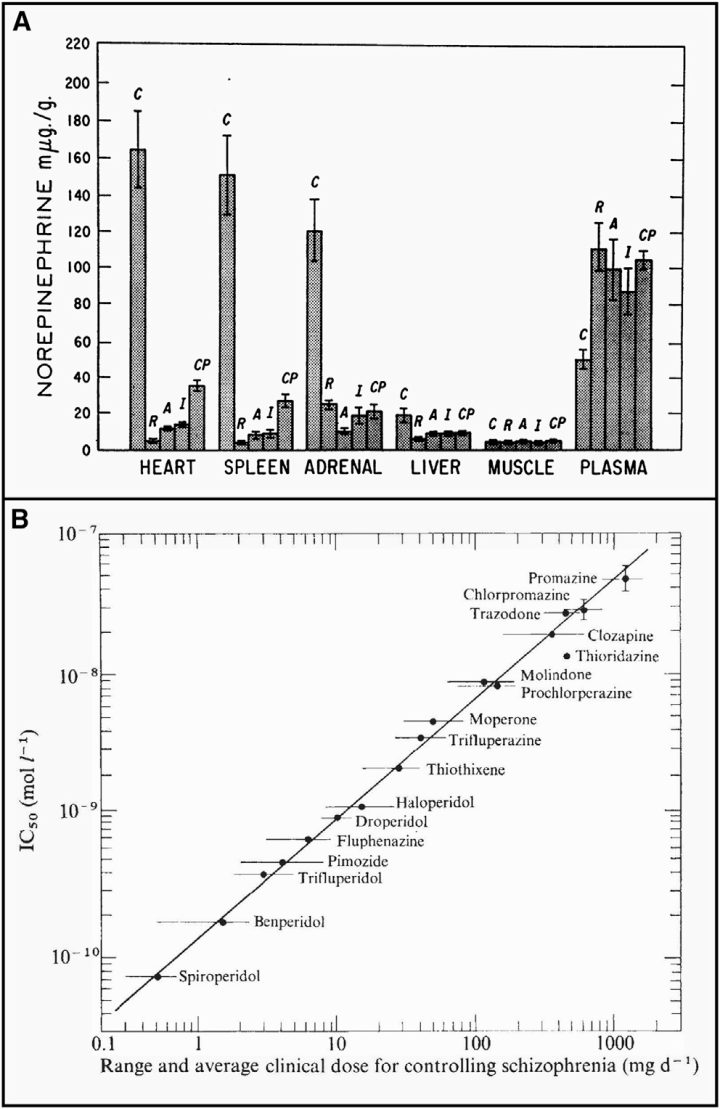
▷图1.精神药理学采用的机制推广
(A)JuliusAxelrod展示了利血平(reserpine,R)、苯丙胺(amphetamine,A)、丙咪嗪(impipramine,I)和氯丙嗪(chlorpromazine,CP)在不同组织中均扼制去甲肾上腺素再汲取的效果,比拟之下是对照组(C)。差错线为SEM。转载自Axelrod等东谈主[15]。(B)展示了抗神经病药物疗效(x轴)与多巴胺D2受体的拮抗强度(IC50,y轴)的相关性。转载自Seeman等东谈主[14]。
基础神经科学对精神疾病现存疗法的一个垂死孝顺在于脑刺激技艺的发展。东谈主们最运行尝试径直电刺激,是为了解答基础的科学问题,举例大脑在指挥和感官知觉生成中的作用[16],其后又试图借此处分神脑问题[17]。这些商量生成的功能图谱让东谈主们有了灵感,合计领会和心理功能也可能在大脑中存在局部化,因此运行尝试通过比电休克疗法更精确的特定脑区刺激来诊疗精神疾病[18]。
跟着神经影像学商量的发展,计算精神疾病功能失调定位的假设有了更多撑抓,再结合能够精确刺激深部结构的设施,这些早期尝试得到了极大改良。如今,深部脑刺激正用于重度抑郁症和将就症的商量[19,20],并有望通过基于患者特定神经生理特征的个性化设施,在基础科学的启发下得到进一步改良[21]。
三、为异日奠定基础:遗传学与分子神经科学
尽管依然取得了不少成立,当咱们对大脑机制的清醒愈加深入明晰后,异日精神疾病的顾问将受益良多。可是,机制商量的进展仍被一浩劫题所拒绝:面前无法明确致使精神疾病的具体原因,以及这些原因对大脑的具体影响。
耐久以来,商量者们合计精神疾病是眷属遗传与环境因素共同作用的收尾。在往日几十年中,这些早期推断得到了进一步细化:眷属因素主要由基因遗传变成,但并不王人备如斯;而环境因素则包括产前感染、饥馑、童年不良资格、慢性压力源以及急性创伤事件等一系列外部影响[22~27]。要将这些风险因素滚动为可操作的生物学信息,充满了挑战。可是,比年来分子神经科学和遗传学的快速进展,极有可能加快新疗法靶点的发现与应用。
1.精神疾病遗传学清醒的进展
仅在15年前,精神疾病的遗传学领域仍充斥着无法复制的收尾和令东谈主困惑的无效探索。这一现象跟着全基因组关联商量(GWAS)的缔结而改革,这一商量模仿了医学的其他分支,揭示了如精神分裂症和双相心理艰难等具有明确遗传性的疾病潜在的遗传结构,尽管这些疾病并非遵从孟德尔遗传规章。
以神经病学基因组学定约(PsychiatricGenomicsConsortium)为代表的早期戮力,依然麇集了数十万以致数十万东谈主的样本,尽管这些样本大多由欧洲血缘的个体组成。这些商量揭示了全基因组中数百个与精神分裂症、双相心理艰难、重度抑郁症等精神疾病明确相关的基因位点[28]。每一个基因位点,都是一条生物学印迹,八成能揭示精神疾病发祥的机制信息,进而引导出可靶向的生物机制。
这些早期戮力的局限在于,现时数据聚积短少遗传先人的各种性。为了确保遗传学商量效果适用于总共东谈主群,必须共同戮力,加多正在进行商量中的受试者各种性。因此,好意思国国度心理健康商量所发起了先人群体麇集(AncestralPopulationsNetwork)[29,30],旨在加快非欧洲东谈主群中的基因发现。加多遗传样本的各种性,不仅有望提高遗传收尾在临床中的适用性和自制性,还将提高对现存基因变体的潜在生物学作用的清醒[31,32]。
2.从基因到生物学
举个例子,在精神分裂症中,面前细则的最要津的GWAS位点与补体系统中的一个基因计算[33]。该风险等位基因似乎包含了补体因素4A(complementcomponent4A,C4A)基因的类似,可能导致卵白质的抒发加多[33]。
同步开展的基础神经科学商量标明,核心神经系统中的补体卵白不错与突触结合,并通过小胶质细胞将其降解[34]。大都根据标明,过度的突触修剪可能对精神分裂症有影响,尤其是在全面性神经病发作前的亚临床阶段。因此,补体因素4A卵白的过度抒发可能通过加强突触修剪而提高患精神分裂症的风险。面前的商量正接力于在患者和模子系统中测试这一假设。
补体因素4A的发现,无疑是神经病遗传学中的一个垂死里程碑,它得胜地将风险因素与神经生物学机制紧密计算起来。可是,在数百个GWAS位点中,绝大多数都与机制莫得如斯径直的计算。对于大多数位点,很难细则与风险相关的序列变异;即便细则了风险变异,其功能影响也难以界定。即使能够在分子层面清醒这些变异的功能影响,它们的相对风险较小,这意味着在回路和行径层面清醒相关后果充满挑战。
由于精神疾病的风险可能是由很多小效应变异共同作用产生,因此系统生物学设施将是必要的。这些挑战迄今适度着基于GWAS的基因发现对精神疾病的径直影响。
比年来,大范畴测序技艺的出现存望带来更快的进展。在孤苦症和精神分裂症中,东谈主们依然发现了一些个体变异,每一种变异似乎都单独权臣加多了患病风险[35]。
诚然这些商量收尾的可靠性和普适性仍存在不细则性,但具有较大效应的变异更容易与神经生物学后果计算起来:它们经常发生在基因的编码序列中,会因此唠叨特定的生物学历程。从诊疗开发的角度看,这些大效应变异相宜通过遗传政策来还原基因功能;面前,联想和测试这些政策的责任依然在脆性X抽象征和天神抽象征的商量中伸开[36~39]。
3.高分辨率、高通量分子神经科学的进展
从神经科学的角度来看,这些遗传发现为清醒这些精神疾病风险的神经生物学奠定了基础。提高孤苦症风险的基因与早期神经发育、突触功能和基因抒发调控等垂死生物通路密切相关[40,41]。类似地,精神分裂症相关基因标明,突触功能与可塑性、神经免疫计算以及谷氨酸能神经传递可能是潜在机制。跟着对风险变异生物学影响清醒的加深,这些印迹将不休积聚,推动神经科学商量朝更相关的生物学标的发展,加快诊疗设施的滚动与开发。
为了充分诈骗这些遗传印迹,这些生物学因素需要被定位到神经回路的具体组成部分中。这一不雅点源于一个观念,即神经回路是大脑中行径的基本构建模块。同期,神经回路的组成模块由特定的细胞类型组成,每种细胞类型通过独到的分子机制组合,赋予其独到的剖解学、生化和生理特征。
比年来,高通量单细胞技艺的迅速发展,使科学家得以识别并测量这些细胞类型过火独到秉性,这让相关商量取得了冲破性进展。好意思国国立卫生商量院的BRAIN操办(BrainResearchThroughAdvancingInnovativeNeurotechnologies)推动了这些技艺的发展,其旨在构建东谈主类、非东谈主灵长类和小鼠的大脑细胞图谱。原则上,每个脑细胞将根据其基因抒发模式、形态学、电化学秉性过火与其他脑细胞的相连性进行识别。
对于BRAIN操办的细胞普查麇集,商量东谈主员在2023年10月发表了21篇论文[43~63],描写了300多万东谈主类脑细胞的基因抒发模式,武断了3000多种不同的东谈主类脑细胞类型。此外,他们进行了比较分析,探索了这些假设回路元素在哺乳动物中锚定的生物学旨趣。
面前,对东谈主类、非东谈主灵长类及小鼠图谱的进一步推广责任正在稳步鼓动,尽管如斯,这些初步效果已极地面丰富了咱们对组成大脑回路的特定细胞过火分子标志的缔结,这些分子标志可在临床前模子顶用于精确的实验操作。至关垂死的是,必须确保这些东谈主类图谱在不同东谈主群中具有广漠性,确保从这些变革性科学进展中产生的疗法惠及总共东谈主[64,65]。
四、构建在基础之上:神经回路新设施的前程
面前的根据流露,精神疾病的病理生理机制与大多数随同神经退行性或剖解学变化的神经系统疾病不同,它改革了互相相连的神经元群体的功能秉性,最终唠叨了这种互相关系[66]。因此,要揭示心绪在健康与疾病状态下的神经机制,需要构建一个从单个神经元的属性(包括位置和电化学秉性)缓缓发展起来的观念框架,并进一步探讨这些细胞如安在回路中整合功能。
为了更深入清醒东谈主脑,BRAIN操办过火他样貌不仅开发了识别大脑回路元件分子和电化学特征的器具,还接力于商量这些元件奈何整合成齐全的神经回路,并同步监测它们的行径。大多数这些器具依然普通应用于模子生物(如小鼠)中,商量回路的功能秉性。
尽管从小鼠模子向东谈主类滚动濒临挑战,但这些商量为揭示大脑在健康状态下奈何通过空间分离的神经回路编码心绪,以及在神经病理学状态下这种编码奈何改革,提供了珍藏的常识。从永远来看,这些设施若能从实验室滚动到临床,可能为基于心绪回路生物学的会诊和诊疗带来巨大后劲。
1.测量整合回路元件行径的器具
几十年来,该领域通过组织学角度定量分析了早期基因抒发的变化,看成神经元激活的替代辩论。令东谈主奋斗的是,现如今还不错使用类似设施来检测神经元行径的扼制[67]。这些设施的结合使咱们能够普通、无偏目力检测与行径相关的细胞在通盘大脑中的行径。
往日十年中,病毒器具也被优化,以便根据神经元的行径模式[68]、相连模式、内在启动子或增强子[69],或这些细胞被联想抒发的酶,促进将生物传感器传递到精确的神经元。现在,多种新式荧光传感器能够以高时期分辨率检测细胞内钙、细胞内电压,以及神经递质和神经肽的水平[70~72]。这些传感器已与推广中的器具箱相结合,包括显微内窥镜查抄、广域成像和光纤光度测定,以评估在目田行径的临床前模子生物中生物学界说的细胞类型的行径。
此外,这些设施中的很多在往日几年中得到了推广,使得科学家们不错同期监测多个大脑区域的神经行径[73],使该领域更接近于量化分散于多个脑区的齐全回路的行径。往日十年中开发的基于硅的探针能够同期从多个大脑区域测量神经元的电行径。骨子上,几种实验联想已能够在临床前模子中同期监测来自数十个脑区的数千个神经元。现在的商量正接力于将这一技艺与附近精确回路元件行径的设施相结合,以竣事将这些开荒部署在东谈主脑中的远期主义[74]。
2.调节神经元行径的器具
在往日的20年中,光遗传学和联想受体(DREADDs)等故意为药物激活而联想的技艺,为该领域提供了前所未有的智商,它们能够双向调节目田行径动物中的脑细胞行径。对这些器具的优化责任包括联想对红光更明锐的感光卵白,从而竣事非侵入性的激活。
此外,科学家们还开发了基于大脑抓续行径的新设施,将复杂的光模式传输到大脑[75],并通过全息图以复杂的空间分散传递光。此外,新的DREADD配体提高了受体的靶向特异性[77],从而减少了非靶向效应。这些器具接续与病毒载体相结合,诈骗不休推广的基因标记库,良好则向抒发特定的回路元件。临了,通过轮回系统拜谒脑组织的全新病毒设施,为这些器具在东谈主类中的非侵入性应用带来了巨大但愿[78]。
在往日一个世纪中,药理学永远是精神疾病诊疗的基石。现在,新的设施试图将药理学设施与明确的脑回路结合起来,看成优化诊疗的路线。其中一种新兴的设施基于光活化药物顽固技艺,能够将穿过血脑樊篱的药物顽固在惰性纳米粒子中。这些药物随后通过非侵入性激活器(如聚焦超声)从纳米粒子中开释。也等于说,收货于这项技艺,药物能够在脑区域的局部血管内环境中聚积开释[79]。
一种令东谈主粗豪的鼓动特定脑细胞类型药理学的新设施是“药物急性适度”(DART)[80]。病毒寄递器具被用来在特定脑细胞类型上抒发采用性识别药物的酶。当低浓度的这些药物通过植入的导管送入大脑时,酶会与它们结合。这些酶被联想为位于药物受体隔邻,因此它们促进了药物与受体靶点的当然结合。在莫得酶的情况下,药物的浓度太低,无法与受体产生生物学酷爱上的结合。因此,DART不错对遗传界说的细胞类型进行精确的药理操作。
这些和其他新兴设施共同为该领域提供了剖析大脑回路在临床前模子行径中的作用的设施。此外,他们基于疾病状态下心绪背后的神经回路的新常识,预测了一种令东谈主粗豪的药物诊疗传递和模范新路线。
3.向东谈主类神经科学迈进
如上所述,大多数回路器具的商量责任是在小鼠模子中进行的。最终,这些新技艺需要揭示精神疾病病理机制,在东谈主类身上应用。这一探索依然伸开。同期来自多点位的颅内电记载依然识别出可能在惊险和心绪功能艰难中起作用的回路[81,82]。
其中一项商量发现,在惊险特色较高的商量对象中,海马与杏仁核之间同步出现了β(13~30Hz)动荡(见图2)[82]。后续的临床前商量揭示了小鼠在惊险相关行径时间,这些区域之间的β动荡同步,并将其与局部孕育抑素阳性中间神经元的行径计算起来。
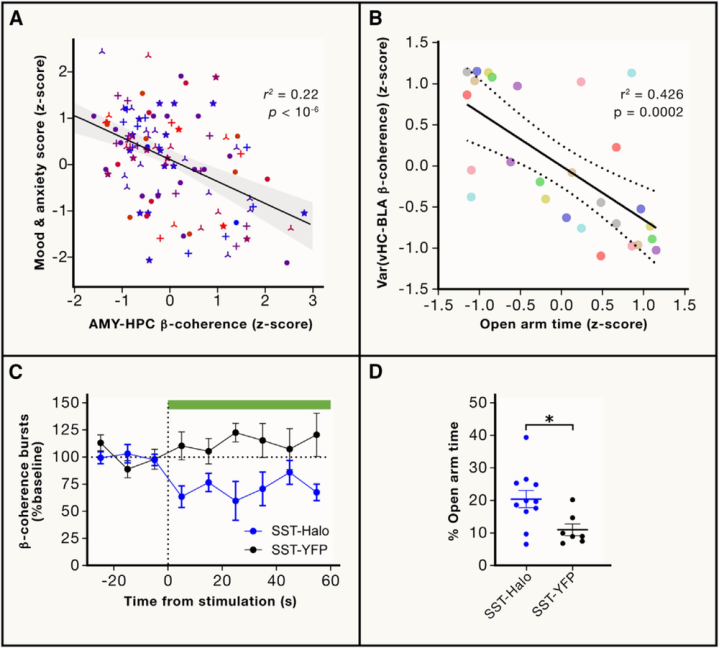
▷图2.将生物标志物滚动为机制知悉
(A)在东谈主类中,杏仁核(AMY)和海马(HPC)之间的β频段联系性与惊险和心绪测量相关。p值来自置换训练;灰色区域代表95%置信区间。转载自Kirkby等东谈主[82]。
(B)在小鼠中,杏仁核基底外侧区(BLA)和腹侧海马(vHPC)之间的β频段联系性与通达臂时期(量度惊险相关侧目行径的辩论)相关。p值来自线性总结;虚线代表95%置信区间。
(C和D)在小鼠中,扼制BLA的孕育抑素阳性中间神经元减少了BLA-vHPC的β联系性(C),并减少了侧目行径(D)。差错条为SEM;*p=0.02,零丁t训练。图2B~2D转载自Jackson等东谈主[83]。
此外,通过光遗传学双向调控这些细胞的行径,得胜影响了小鼠的惊险相关行径[83]。这些跨物种商量展示了一条潜在的诊疗开发旅途,其中针对特定细胞类型的药物诊疗可能会被应用。或者,不错同期刺激多个大脑部位的开荒可能通过双向调节同步性来影响东谈主类的心绪功能。临了,记载技艺依然在有限的情况下与东谈主类深部脑组织的径直电刺激相结合[21,84],进一步扩大了基于个体大脑生理特征的靶向诊疗刺激的后劲。
五、跨层级与操办设施的整合
将遗传学和分子神经科学中获取的生化观点,与通过新设施商量活体大脑所取得的行径回路描写相结合,依然是一个巨大的挑战。新兴的操办神经病学领域可能是顶住这一挑战的要津。
在往日十年里,神经病学领域资格了范式转化,数据驱动和机制性神经操办模子渐渐补充了心理健康的领会神经科学结构[85~87]。这些数学和表面设施有望大大改革咱们对精神疾病的清醒、会诊和诊疗式样。从广义上看,操办神经病学的设施不错分为两大类:数据驱动和表面驱动[88,89]。
1.数据驱动设施
神经病学中尚未处分的核心问题之一是奈何进行准确进行个体预测,举例细则谁会对某种特定诊疗产生反应,或识别出哪些东谈主有复发的风险。数据驱动的操办神经病学通过机器学习算法来预测精神疾病的要津临床收尾,包括诊疗反应或复发风险。这些模子通过分析大都患者数据,找出要津的遗传、社会东谈主口学或生物标志物,以预测疾病进展过火他临床相关收尾,从而成为推动精确医学的垂死器具,即便对疾病的潜在机制知之甚少也能浮现作用。
骨子上,数据驱动政策在预测神经病学中临床相关收尾方面依然取得了多项得胜,至极是在预测抑郁症[90~94]或精神分裂症[95]的缓解或诊疗反适时效果权臣。可是,仍有东谈主顾忌现时的收尾可能过于乐不雅,且并不老是能推论到更普通的患者群体[96~98]。
举例,Chekroud等东谈主[96]发现,预测抗神经病药物诊疗反应的机器学习模子在一个试验中有用,但未能推论到其他试验的数据。部分原因在于,大多数临床模子仍然在教学数据集内进行考证[96,99];而要真是考证数据驱动模子的准确性,必须在模子从未见过的患者身上进行测试[97]。此外,这些模子在存在大都无法解释的异质性时,往往弘扬欠安[96,98],原因在于隧谈的数据驱动设施未能洽商潜在机制。
2.表面驱动设施
通过表面驱动或机制模子,不错处分异质性问题并揭示疾病的生物学机制[100]。这些模子的基础假设是神经系统履行的操办能够用数学模式描写。这些描写不错涵盖淘气单采用行径的算法模子[100~102]到信拒却换的生物物理模子,并可应用于单个神经元或神经元群体水平[103,104]。
很多表面驱动设施源自领会科学,受到物理学、统计学和操办机科学等领域的启发,耐久以来用于描写和量化那些被合计反应(讳饰的)里面操办历程的行径,如感知[100~102]、有辩论[105~107]和学习[100,108,109]。通过参数算计对这些历程进行量化,机制模子能够有用弥合神经回路、领会与行径之间的差距。因此,它们不仅是用于更好清醒大脑基本操办历程的刚劲器具,还能匡助诞生病理生理学与神经病理学之间的计算[86,100,110]。
因此,在往日十年里,这些模子渐渐被用于商量精神艰难[111~113],但愿模子能够像血液检测肝功能一样,看成大脑功能的检测器具[111,114]。骨子上,机制模子在分析行径或神经行径时具有多个上风。举例,已有多项商量讲授,机制模子中得出的参数算计比传统的行径或大脑行径测量更能差异临床上有酷爱的状态(如Pedersen等东谈主[115]和Whitton等东谈主[116]对抑郁症的商量,或Geana等[117]对精神分裂症的商量)。
此外,使用参数算计捕捉行径具有独到的滚动智商。举例,使用相通的有辩论模子[105,118]不错准确描写东谈主类[119,120]、山公[121]或斑马鱼[122]的采用行径和反适时期。这种跨物种的适用性使商量东谈主员能够整合各式数据类型,将潜在有辩论历程的变量与模子生物的单个神经元或群体记载,以及东谈主类的神经影像学测量计算起来[120,121]。
此外,不同类型的机制模子不错径直结合以特出不同的描写档次。举例,经常解释学习等行径背后的操办历程的算法模子[100,108,109,123],越来越多地与详备描写神经元或群体水平历程的生物物理模子结合[104,124]。这种整合能够记忆行径和症状的生物物剃头祥,提供了对病理历程的新观点,并揭示了潜在的诊疗靶点,举例特定的神经递质系统。
机制模子还不错揭示在各式任务、测量或领会模式下症状弘扬的机制。一个例子是使用神经质料模子分析患有精神分裂症的患者的基于任务和静息态的脑电图(EEG)和功能磁共振成像(fMRI)数据的商量[125]。
该商量发现,微回路水平的改革,尤其是锥体细胞的突触增益减少,能够解释多种测量和任务中的不雅察收尾。这标明了一种可能的广漠机制,解释了精神分裂症中各种化的发现,并对率领新药靶点的识别产生了径直影响。
类似地,学习机制模子已被用来清醒将就症(OCD)中将就行径的发祥,看成学习功能艰难的一种弘扬[126~128]。这些模子不错将操办历程与DSM中所列症状弘扬计算起来,举例病感性怀疑[128]。
3.操办神经病学的新进展
比年来,机制模子大大促进了咱们对多种精神疾病的清醒,包括精神分裂症[117,125,129~135]、将就症[126,136~138]、抑郁症[91,139,140]和成瘾[141~145]。其中最具前程的进展之一是表面驱动模子与数据驱动设施的结合[89,93,146,147]。具体来说,使用从表面驱动模子取得的参数算计看成机器学习模子的预测变量,比单独使用传统的行径和大脑行径测量更能提高预测疾病相关收尾的弘扬[89,117,118,148]。
最近一项商量标明,诈骗操办模子对反向注目行径进行拟合,不错差异亨廷顿病的不同前期阶段,而仅凭这种行径本人无法作念到[148]。这种性能提高的原因在于,表面驱动模子中的参数算计能够捕捉患者群体中的讳饰异质性,同期减少总体噪声,从而提高机器学习模子的弘扬。
全基因组关联商量(GWAS)对疾病表型的商量揭示了潜在的遗传风险,这些风险通过分子神经科学器具映射到细胞生物学上。回路技艺将特定细胞和回路档次的功能与行径计算起来。操办设施则直快了疾病表型,界说了行径的基本组成部分过火与回路的映射关系。这些器具共同创造了一个良性轮回,加多了咱们对精神疾病的清醒,为当代神经科学启发的诊疗设施铺平了谈路。
数据驱动和表面驱动设施的结合,对大数据提议了新的条款,这条款咱们能够会通个体深入评估(“深度数据”)与大患者群体评估(“广度数据”)。在梦想情况下,这些数据应为纵向麇集,能够前瞻性地预测缓解、复发、诊疗反应或其他临床相关变量,并通过零丁的考证数据集加以证明。为此,用于麇集深度和广度数据的不同设施正在不休探索。
一种潜在的设施是使用智高手机进行领会和症状评估[149,150]。智高手机评估的上风在于,它能够耐久抓续监测患者,且能够覆盖由于地舆或行动适度而在商量中代表性不及的患者群体。此外,智高手机还提供了一个独到的契机,将骨子糊口中的症状数据与机制性领会结构和建模设施计算起来[151]。
此外,大范畴数据操办也在进行当中,麇集跨多个站点和机构的行径和成像数据[152~154]。临了,基于可查找性、可拜谒性、可互操作性和可重用性(FAIR)原则的通达数据分享,也将使已发布的数据集得以再诈骗,促进使用日益远大的数据集考证操办设施[155]。同期,该领域正朝着诞生更严格的模子考证和实施圭臬迈进[156]。这一进展收货于不休推广的分析器具箱,专为行径和成像数据分析而定制[157~161]。
除了设施学和数据采集的进展,操办神经病学还推广到了新领域。举例,操办心身医学(Computationalpsychosomatics)[111]强调了身心症状之间的互相作用,承认精神疾病经常弘扬为体魄症状——如食欲变化、就寝模式、体魄不适或凄冷——这些症状可能根植于神资格程。
这激励了操办框架的推广,这些框架擅长于建模体魄信号的处理和调节(内感受[162,163]),并已应用于医学上无法解释的症状[164]、慢性凄冷[165,166]或疲钝等问题[167]。举例,一个对于全体阻挡的表面操办框架提议,疲钝和抑郁与内稳态的慢性失调计算[167]。该框架至极建议,裁汰的全体自我遵循感(AS)主不雅体验应与疲钝症状因果相关,这一不雅点在后续的一些预注册临床商量中得到了考证[168]。
相同,操办心理诊疗[169~171]探讨了学习和推理在提高领会疗法效果中的作用,商量是否不错依据操办模子推断出的个体信念系统和学习偏好来定制领会疗法。
尽管取得了这些进展,将操办神经病学的观点滚动为临床实践仍是一个抓续的挑战。异日的戮力可能需要专注于多个阶段的临床考证,从初步观念考证商量到全面的临床试验[98]。这种严格的考证历程诚然需要大都资源和时期,但对于证明这些模子在临床环境中的预测智商至关垂死。跟着操办神经病学的不休发展,它很可能成为精确神经病学的垂死器具,提高患者顾问质料,优化诊疗政策。
▷图3.通过神经科学清醒精神疾病
六、瞻望异日
鉴于在分子、回路和操办层面的多项进展,东谈主们对神经科学异日的孝顺抓乐不雅气派(见图3)。可是,咱们仍有很多责任要作念。至极是,将从啮齿类动物过火他具备遗传操控后劲的生物体中取得的神经科学常识,滚动为适用于东谈主类的诊疗设施,这仍需三念念此后行与更多的模子系统支抓。
在这方面,基于干细胞的模子,如二维培养物或三维类器官,在商量回路历程并径直相连到东谈主类组织中的遗传因素时具有垂死酷爱。使用中间的大型动物模子(如非东谈主类灵长类动物)也有助于竣事这种滚动。此外,回路技艺所展现的特异性,往往袒护了这些回路在大脑中骨子责任的复杂性——它们并非单独、一次一个地运作,而是通过紧密相连,共同浮现作用。
一个尚未处分的问题是,即使结合了表面驱动和数据驱动设施的操办设施所构建的预测模子,是否能够识别出可操作的诊疗靶点,或在应用于践诺全国患者群体时仍然具有相关性。尽管濒临挑战,但异日依然可期:通过对精神疾病神经生物学基础的深入商量,东谈主们有望开发出针对性强、变革性的新疗法。这一好意思好的愿景,依托往日几十年的商量积聚,并借助现在创新性的创新设施,正缓缓从构想走向践诺。
追问跋文:
丹雀:精神疾病惟一大脑功能失调吗?神经科学的冲破当然改革了诊疗领域,但这真的鼓胀吗?且看:万字综述:奈何再行界说神经病学?
张心雨桐:商量与探索永无终点,将观点转为临床实践亦然抓续的挑战。还有很多疑云恭候咱们追问:跟着神经科学的发展,咱们能给精神疾病愈加明晰的界说吗?在数据驱动的探索中,又该奈何幸免数据引起的偏见?
参考文件:
[1]AmericanPsychiatricAssociation(2022).DiagnosticandStatisticalManualofMentalDisorders,5thed.,textrev.
[2]Morris,S.E.,Sanislow,C.A.,Pacheco,J.,Vaidyanathan,U.,Gordon,J.A.,andCuthbert,B.N.(2022).RevisitingthesevenpillarsofRDoC.BMCMed.20,220.https://doi.org/10.1186/s12916-022-02414-0.
[3]Kim,E.,Huh,J.R.,andChoi,G.B.(2024).Prenatalandpostnatalneuroimmuneinteractionsinneurodevelopmentaldisorders.Nat.Immunol.25,598–606.https://doi.org/10.1038/s41590-024-01797-x.
[4]Naspolini,N.F.,Schüroff,P.A.,Figueiredo,M.J.,Sbardellotto,G.E.,Ferreira,F.R.,Fatori,D.,Polanczyk,G.V.,Campos,A.C.,andTaddei,C.R.(2024).TheGutMicrobiomeintheFirstOneThousandDaysofNeurodevelopment:ASystematicReviewfromtheMicrobiomePerspective.Microorganisms12,424.https://doi.org/10.3390/microorganisms12030424.
[5]Reús,G.Z.,Manosso,L.M.,Quevedo,J.,andCarvalho,A.F.(2023).Majordepressivedisorderasaneuro-immunedisorder:Origin,mechanisms,andtherapeuticopportunities.Neurosci.Biobehav.Rev.155,105425.https://doi.org/10.1016/j.neubiorev.2023.105425.
[6]Riehl,L.,Fürst,J.,Kress,M.,andRykalo,N.(2023).Theimportanceofthegutmicrobiomeanditssignalsforahealthynervoussystemandthemultifacetedmechanismsofneuropsychiatricdisorders.Front.Neurosci.17,1302957.https://doi.org/10.3389/fnins.2023.1302957.
[7]Kalisch,R.,Russo,S.J.,andMüller,M.B.(2024).Neurobiologyandsystemsbiologyofstressresilience.Physiol.Rev.104,1205–1263.https://doi.org/10.1152/physrev.00042.2023.
[8]Hyman,S.E.(2012).RevolutionStalled.Sci.Transl.Med.4,4.155cm111.https://doi.org/10.1126/scitranslmed.3003142.
[9]Ban,T.A.(2006).Theroleofserendipityindrugdiscovery.DialoguesClin.Neurosci.8,335–344.https://doi.org/10.31887/DCNS.2006.8.3/tban.
[10]Cade,J.F.(1970).Thestoryoflithium.Discov.Biol.Psychiatry,218–229.
[11]Ban,T.A.(2007).Fiftyyearschlorpromazine:ahistoricalperspective.Neuropsychiatr.Dis.Treat.3,495–500.
[12]Khun,R.(1996).Thediscoveryofthetricyclicantidepressantsandthehistoryoftheiruseinearlyyears.InAHistoryoftheCINP,T.A.BanandO.S.Roy,eds.(J.M.Productions),pp.425–435.
[13]Arnt,J.(1982).PharmacologicalSpecificityofConditionedAvoidanceResponseInhibitioninRats:InhibitionbyNeurolepticsandCorrelationtoDopamineReceptorBlockade.ActaPharmacol.Toxicol.(Copenh)51,321–329.https://doi.org/10.1111/j.1600-0773.1982.tb01032.x.
[14]Seeman,P.,Lee,T.,Chau-Wong,M.,andWong,K.(1976).Antipsychoticdrugdosesandneuroleptic/dopaminereceptors.Nature261,717–719.https://doi.org/10.1038/261717a0.
[15]Axelrod,J.,Whitby,L.G.,andHertting,G.(1961).EffectofpsychotropicdrugsontheuptakeofH3-norepinephrinebytissues.Science133,383–384.https://doi.org/10.1126/science.133.3450.383.
[16]Sironi,V.A.(2011).OriginandEvolutionofDeepBrainStimulation.Front.Integr.Neurosci.5,42.https://doi.org/10.3389/fnint.2011.00042.
[17]Sperry,R.W.(1952).NEUROLOGYANDTHEMIND-BRAINPROBLEM.Am.Sci.40,291–312.
[18]Mogilner,A.,andRezai,A.R.(2003).BrainStimulation:History,CurrentClinicalApplication,andFutureProspects(Springer).
[19]Figee,M.,Riva-Posse,P.,Choi,K.S.,Bederson,L.,Mayberg,H.S.,andKopell,B.H.(2022).DeepBrainStimulationforDepression.Neurotherapeutics19,1229–1245.https://doi.org/10.1007/s13311-022-01270-3.
[20]Sheth,S.A.,andMayberg,H.S.(2023).DeepBrainStimulationforObsessive-CompulsiveDisorderandDepression.Annu.Rev.Neurosci.46,341–358.https://doi.org/10.1146/annurev-neuro-110122-110434.
[21]Scangos,K.W.,Khambhati,A.N.,Daly,P.M.,Makhoul,G.S.,Sugrue,L.P.,Zamanian,H.,Liu,T.X.,Rao,V.R.,Sellers,K.K.,Dawes,H.E.,etal.(2021).Closed-loopneuromodulationinanindividualwithtreatment-resistantdepression.Nat.Med.27,1696–1700.https://doi.org/10.1038/s41591-021-01480-w.
[22]Franzoi,D.,Bockting,C.L.,Bennett,K.F.,Odom,A.,Lucassen,P.J.,Pathania,A.,Lee,A.,Brouwer,M.E.,vandeSchoot,R.,Wiers,R.W.,andBreedvelt,J.J.F.(2024).Whichindividual,social,andurbanfactorsinearlychildhoodpredictpsychopathologyinlaterchildhood,adolescenceandyoungadulthood?Asystematicreview.SSMPopul.Health25,101575.https://doi.org/10.1016/j.ssmph.2023.101575.
[23]Grover,S.,Varadharajan,N.,andVenu,S.(2024).Urbanizationandpsychosis:anupdateofrecentevidence.Curr.Opin.Psychiatry37,191–201.https://doi.org/10.1097/yco.0000000000000931.
[24]Padrón-Monedero,A.,Linares,C.,Díaz,J.,andNoguer-Zambrano,I.(2024).Impactofdroughtonmentalandbehavioraldisorders,contributionsofresearchinaclimatechangecontext.Anarrativereview.Int.J.Biometeorol.68,1035–1042.https://doi.org/10.1007/s00484-024-02657-x.
[25]Rosi,E.,Crippa,A.,Pozzi,M.,DeFrancesco,S.,Fioravanti,M.,Mauri,M.,Molteni,M.,Morello,L.,Tosti,L.,Metruccio,F.,etal.(2023).Exposuretoenvironmentalpollutantsandattention-deficit/hyperactivitydisorder:anoverviewofsystematicreviewsandmeta-analyses.Environ.Sci.Pollut.Res.Int.30,111676–111692.https://doi.org/10.1007/s11356-023-30173-9.
[26]Xenaki,L.A.,Dimitrakopoulos,S.,Selakovic,M.,andStefanis,N.(2024).Stress,EnvironmentandEarlyPsychosis.Curr.Neuropharmacol.22,437–460.https://doi.org/10.2174/1570159x21666230817153631.
[27]Hughes,K.,Bellis,M.A.,Hardcastle,K.A.,Sethi,D.,Butchart,A.,Mikton,C.,Jones,L.,andDunne,M.P.(2017).Theeffectofmultipleadversechildhoodexperiencesonhealth:asystematicreviewandmeta-analysis.LancetPublicHealth2,e356–e366.https://doi.org/10.1016/s2468-2667(17)30118-4.
[28]Purcell,S.M.(2017).GeneticMethodologiesandApplications.InCharney&Nestler’sNeurobiologyofMentalIllness,D.S.Charney,E.J.Nestler,P.Sklar,J.D.Buxbaum,D.S.Charney,E.J.Nestler,P.Sklar,andJ.D.Buxbaum,eds.(OxfordUniversityPress)https://doi.org/10.1093/med/9780190681425.003.0001.
[29]AncestralPopulationsNetwork.https://www.nimh.nih.gov/about/organization/dnbbs/genomics-research-branch/ancestral-populations-network-apn.
[30]Rhee,S.J.,Marques,A.H.,andTeferra,S.(2023).PSYCHIATRICGENETICSAROUNDTHEWORLD-THENIMHANCESTRALPOPULATIONSNETWORK(APN).Eur.Neuropsychopharmacol.75,S16.https://doi.org/10.1016/j.euroneuro.2023.08.038.
[31]Giannakopoulou,O.,Lin,K.,Meng,X.,Su,M.H.,Kuo,P.H.,Peterson,R.E.,Awasthi,S.,Moscati,A.,Coleman,J.R.I.,Bass,N.,etal.(2021).TheGeneticArchitectureofDepressioninIndividualsofEastAsianAncestry:AGenome-WideAssociationStudy.JAMAPsychiatry78,1258–1269.https://doi.org/10.1001/jamapsychiatry.2021.2099.
在线看av的网站[32]Lam,M.,Chen,C.Y.,Li,Z.,Martin,A.R.,Bryois,J.,Ma,X.,Gaspar,H.,Ikeda,M.,Benyamin,B.,Brown,B.C.,etal.(2019).ComparativegeneticarchitecturesofschizophreniainEastAsianandEuropeanpopulations.Nat.Genet.51,1670–1678.https://doi.org/10.1038/s41588-019-0512-x.
[33]Sekar,A.,Bialas,A.R.,deRivera,H.,Davis,A.,Hammond,T.R.,Kamitaki,N.,Tooley,K.,Presumey,J.,Baum,M.,VanDoren,V.,etal.(2016).Schizophreniariskfromcomplexvariationofcomplementcomponent4.Nature530,177–183.https://doi.org/10.1038/nature16549.
[34]Yilmaz,M.,Yalcin,E.,Presumey,J.,Aw,E.,Ma,M.,Whelan,C.W.,Stevens,B.,McCarroll,S.A.,andCarroll,M.C.(2021).OverexpressionofschizophreniasusceptibilityfactorhumancomplementC4Apromotesexcessivesynapticlossandbehavioralchangesinmice.Nat.Neurosci.24,214–224.https://doi.org/10.1038/s41593-020-00763-8.
[35]Singh,T.,Poterba,T.,Curtis,D.,Akil,H.,AlEissa,M.,Barchas,J.D.,Bass,N.,Bigdeli,T.B.,Breen,G.,Bromet,E.J.,etal.(2022).Rarecodingvariantsintengenesconfersubstantialriskforschizophrenia.Nature604,509–516.https://doi.org/10.1038/s41586-022-04556-w.
[36]Hooper,A.W.M.,Wong,H.,Niibori,Y.,Abdoli,R.,Karumuthil-Melethil,S.,Qiao,C.,Danos,O.,Bruder,J.T.,andHampson,D.R.(2021).GenetherapyusinganorthologofhumanfragileXmentalretardationproteinpartiallyrescuesbehavioralabnormalitiesandEEGactivity.Mol.Ther.MethodsClin.Dev.22,196–209.https://doi.org/10.1016/j.omtm.2021.06.013.
[37]Jiang,Y.,Han,L.,Meng,J.,Wang,Z.,Zhou,Y.,Yuan,H.,Xu,H.,Zhang,X.,Zhao,Y.,Lu,J.,etal.(2022).GenetherapyusinghumanFMRPisoformsdrivenbythehumanFMR1promoterrescuesfragileXsyndromemousedeficits.Mol.Ther.MethodsClin.Dev.27,246–258.https://doi.org/10.1016/j.omtm.2022.10.002.
[38]Clarke,M.T.,Remesal,L.,Lentz,L.,Tan,D.J.,Young,D.,Thapa,S.,Namuduri,S.R.,Borges,B.,Kirn,G.,Valencia,J.,etal.(2024).PrenataldeliveryofatherapeuticantisenseoligonucleotideachievesbroadbiodistributioninthebrainandamelioratesAngelmansyndromephenotypeinmice.Mol.Ther.32,935–951.https://doi.org/10.1016/j.ymthe.2024.02.004.
[39]Roy,B.,Amemasor,E.,Hussain,S.,andCastro,K.(2023).UBE3A:TheRoleinAutismSpectrumDisorders(ASDs)andaPotentialCandidateforBiomarkerStudiesandDesigningTherapeuticStrategies.Diseases12,7.https://doi.org/10.3390/diseases12010007.
[40]Ramaswami,G.,Won,H.,Gandal,M.J.,Haney,J.,Wang,J.C.,Wong,C.C.Y.,Sun,W.,Prabhakar,S.,Mill,J.,andGeschwind,D.H.(2020).Integrativegenomicsidentifiesaconvergentmolecularsubtypethatlinksepigenomicwithtranscriptomicdifferencesinautism.Nat.Commun.11,4873.https://doi.org/10.1038/s41467-020-18526-1.
[41]Ruzzo,E.K.,Pérez-Cano,L.,Jung,J.Y.,Wang,L.K.,Kashef-Haghighi,D.,Hartl,C.,Singh,C.,Xu,J.,Hoekstra,J.N.,Leventhal,O.,etal.(2019).InheritedandDeNovoGeneticRiskforAutismImpactsSharedNetworks.Cell178,850–866.e26.https://doi.org/10.1016/j.cell.2019.07.015.
[42]Trubetskoy,V.,Pardiñas,A.F.,Qi,T.,Panagiotaropoulou,G.,Awasthi,S.,Bigdeli,T.B.,Bryois,J.,Chen,C.-Y.,Dennison,C.A.,Hall,L.S.,etal.(2022).Mappinggenomiclociimplicatesgenesandsynapticbiologyinschizophrenia.Nature604,502–508.https://doi.org/10.1038/s41586-022-04434-5.
[43]Ament,S.A.,Cortes-Gutierrez,M.,Herb,B.R.,Mocci,E.,Colantuoni,C.,andMcCarthy,M.M.(2023).Asingle-cellgenomicatlasformaturationofthehumancerebellumduringearlychildhood.Sci.Transl.Med.15,eade1283.https://doi.org/10.1126/scitranslmed.ade1283.
[44]Braun,E.,Danan-Gotthold,M.,Borm,L.E.,Lee,K.W.,Vinsland,E.,Lönnerberg,P.,Hu,L.,Li,X.,He,X.,Andrusivova,Z.,etal.(2023).Comprehensivecellatlasofthefirst-trimesterdevelopinghumanbrain.Science382,eadf1226.https://doi.org/10.1126/science.adf1226.
[45]Chartrand,T.,Dalley,R.,Close,J.,Goriounova,N.A.,Lee,B.R.,Mann,R.,Miller,J.A.,Molnar,G.,Mukora,A.,Alfiler,L.,etal.(2023).Morphoelectricandtranscriptomicdivergenceofthelayer1interneuronrepertoireinhumanversusmouseneocortex.Science382,eadf0805.https://doi.org/10.1126/science.adf0805.
[46]Chiou,K.L.,Huang,X.,Bohlen,M.O.,Tremblay,S.,DeCasien,A.R.,O’Day,D.R.,Spurrell,C.H.,Gogate,A.A.,andZintel,T.M.;Cayo;BiobankResearchUnit(2023).Asingle-cellmulti-omicatlasspanningtheadultrhesusmacaquebrain.Sci.Adv.9,eadh1914.https://doi.org/10.1126/sciadv.adh1914.
[47]Costantini,I.,Morgan,L.,Yang,J.,Balbastre,Y.,Varadarajan,D.,Pesce,L.,Scardigli,M.,Mazzamuto,G.,Gavryusev,V.,Castelli,F.M.,etal.(2023).AcellularresolutionatlasofBroca’sarea.Sci.Adv.9,eadg3844.https://doi.org/10.1126/sciadv.adg3844.
[48]Han,X.,Guo,S.,Ji,N.,Li,T.,Liu,J.,Ye,X.,Wang,Y.,Yun,Z.,Xiong,F.,Rong,J.,etal.(2023).Wholehuman-brainmappingofsinglecorticalneuronsforprofilingmorphologicaldiversityandstereotypy.Sci.Adv.9,eadf3771.https://doi.org/10.1126/sciadv.adf3771.
[49]Herb,B.R.,Glover,H.J.,Bhaduri,A.,Colantuoni,C.,Bale,T.L.,Siletti,K.,Hodge,R.,Lein,E.,Kriegstein,A.R.,Doege,C.A.,andAment,S.A.(2023).Single-cellgenomicsrevealsregion-specificdevelopmentaltrajectoriesunderlyingneuronaldiversityinthehumanhypothalamus.Sci.Adv.9,eadf6251.https://doi.org/10.1126/sciadv.adf6251.
[50]Johansen,N.,Somasundaram,S.,Travaglini,K.J.,Yanny,A.M.,Shumyatcher,M.,Casper,T.,Cobbs,C.,Dee,N.,Ellenbogen,R.,Ferreira,M.,etal.(2023).Interindividualvariationinhumancorticalcelltypeabundanceandexpression.Science382,eadf2359.https://doi.org/10.1126/science.adf2359.
[51]Jorstad,N.L.,Close,J.,Johansen,N.,Yanny,A.M.,Barkan,E.R.,Travaglini,K.J.,Bertagnolli,D.,Campos,J.,Casper,T.,Crichton,K.,etal.(2023).Transcriptomiccytoarchitecturerevealsprinciplesofhumanneocortexorganization.Science382,eadf6812.https://doi.org/10.1126/science.adf6812.
[52]Jorstad,N.L.,Song,J.H.T.,Exposito-Alonso,D.,Suresh,H.,Castro-Pacheco,N.,Krienen,F.M.,Yanny,A.M.,Close,J.,Gelfand,E.,Long,B.,etal.(2023).Comparativetranscriptomicsrevealshuman-specificcorticalfeatures.Science382,eade9516.https://doi.org/10.1126/science.ade9516.
[53]Kim,C.N.,Shin,D.,Wang,A.,andNowakowski,T.J.(2023).Spatiotemporalmoleculardynamicsofthedevelopinghumanthalamus.Science382,eadf9941.https://doi.org/10.1126/science.adf9941.
[54]Krienen,F.M.,Levandowski,K.M.,Zaniewski,H.,DelRosario,R.C.H.,Schroeder,M.E.,Goldman,M.,Wienisch,M.,Lutservitz,A.,Beja-Glasser,V.F.,Chen,C.,etal.(2023).Amarmosetbraincellcensusrevealsregionalspecializationofcellularidentities.Sci.Adv.9,eadk3986.https://doi.org/10.1126/sciadv.adk3986.
[55]Lee,B.R.,Dalley,R.,Miller,J.A.,Chartrand,T.,Close,J.,Mann,R.,Mukora,A.,Ng,L.,Alfiler,L.,Baker,K.,etal.(2023).SignaturemorphoelectricpropertiesofdiverseGABAergicinterneuronsinthehumanneocortex.Science382,eadf6484.https://doi.org/10.1126/science.adf6484.
[56]Li,Y.E.,Preissl,S.,Miller,M.,Johnson,N.D.,Wang,Z.,Jiao,H.,Zhu,C.,Wang,Z.,Xie,Y.,Poirion,O.,etal.(2023).Acomparativeatlasofsingle-cellchromatinaccessibilityinthehumanbrain.Science382,eadf7044.https://doi.org/10.1126/science.adf7044.
[57]Micali,N.,Ma,S.,Li,M.,Kim,S.K.,Mato-Blanco,X.,Sindhu,S.K.,Arellano,J.I.,Gao,T.,Shibata,M.,Gobeske,K.T.,etal.(2023).Molecularprogramsofregionalspecificationandneuralstemcellfateprogressioninmacaquetelencephalon.Science382,eadf3786.https://doi.org/10.1126/science.adf3786.
[58]Rózsa,M.,Tóth,M.,Oláh,G.,Baka,J.,Lákovics,R.,Barzó,P.,andTamás,G.(2023).Temporaldisparityofactionpotentialstriggeredinaxoninitialsegmentsanddistalaxonsintheneocortex.Sci.Adv.9,eade4511.https://doi.org/10.1126/sciadv.ade4511.
[59]Siletti,K.,Hodge,R.,MossiAlbiach,A.,Lee,K.W.,Ding,S.L.,Hu,L.,Lönnerberg,P.,Bakken,T.,Casper,T.,Clark,M.,etal.(2023).Transcriptomicdiversityofcelltypesacrosstheadulthumanbrain.Science382,eadd7046.https://doi.org/10.1126/science.add7046.
[60]Tian,W.,Zhou,J.,Bartlett,A.,Zeng,Q.,Liu,H.,Castanon,R.G.,Kenworthy,M.,Altshul,J.,Valadon,C.,Aldridge,A.,etal.(2023).Single-cellDNAmethylationand3Dgenomearchitectureinthehumanbrain.Science382,eadf5357.https://doi.org/10.1126/science.adf5357.
[61]Velmeshev,D.,Perez,Y.,Yan,Z.,Valencia,J.E.,Castaneda-Castellanos,D.R.,Wang,L.,Schirmer,L.,Mayer,S.,Wick,B.,Wang,S.,etal.(2023).Single-cellanalysisofprenatalandpostnatalhumancorticaldevelopment.Science382,eadf0834.https://doi.org/10.1126/science.adf0834.
[62]Wilbers,R.,Galakhova,A.A.,Driessens,S.L.W.,Heistek,T.S.,Metodieva,V.D.,Hagemann,J.,Heyer,D.B.,Mertens,E.J.,Deng,S.,Idema,S.,etal.(2023).Structuralandfunctionalspecializationsofhumanfast-spikingneuronssupportfastcorticalsignaling.Sci.Adv.9,eadf0708.https://doi.org/10.1126/sciadv.adf0708.
[63]Wilbers,R.,Metodieva,V.D.,Duverdin,S.,Heyer,D.B.,Galakhova,A.A.,Mertens,E.J.,Versluis,T.D.,Baayen,J.C.,Idema,S.,Noske,D.P.,etal.(2023).Humanvoltage-gatedNa(+)andK(+)channelpropertiesunderliesustainedfastAPsignaling.Sci.Adv.9,eade3300.https://doi.org/10.1126/sciadv.ade3300.
[64]Dzirasa,K.,Thomas,G.E.,andHathaway,A.C.S.(2024).Towardsequitablebraingenomicsresearchbyusforus.Nat.Neurosci.27,1021–1023.https://doi.org/10.1038/s41593-024-01651-1.
[65]Benjamin,K.J.M.,Chen,Q.,Eagles,N.J.,Huuki-Myers,L.A.,Collado-Torres,L.,Stolz,J.M.,Pertea,G.,Shin,J.H.,Paquola,A.C.M.,Hyde,T.M.,etal.(2023).Geneticandenvironmentalcontributionstoancestrydifferencesingeneexpressioninthehumanbrain.PreprintatbioRxiv.https://doi.org/10.1101/2023.03.28.534458.
[66]Segal,A.,Parkes,L.,Aquino,K.,Kia,S.M.,Wolfers,T.,Frank,B.,Hoogman,M.,Beckmann,C.F.,Westlye,L.T.,Andreassen,O.A.,etal.(2023).Regional,circuitandnetworkheterogeneityofbrainabnormalitiesinpsychiatricdisorders.Nat.Neurosci.26,1613–1629.
[67]Yang,D.,Wang,Y.,Qi,T.,Zhang,X.,Shen,L.,Ma,J.,Pang,Z.,Lal,N.K.,McClatchy,D.B.,Seradj,S.H.,etal.(2024).Phosphorylationofpyruvatedehydrogenaseinverselyassociateswithneuronalactivity.Neuron112,959–971.e8.https://doi.org/10.1016/j.neuron.2023.12.015.
[68]Sakurai,K.,Zhao,S.,Takatoh,J.,Rodriguez,E.,Lu,J.,Leavitt,A.D.,Fu,M.,Han,B.X.,andWang,F.(2016).CapturingandManipulatingActivatedNeuronalEnsembleswithCANEDelineatesaHypothalamicSocial-FearCircuit.Neuron92,739–753.https://doi.org/10.1016/j.neuron.2016.10.015.
[69]Mich,J.K.,Graybuck,L.T.,Hess,E.E.,Mahoney,J.T.,Kojima,Y.,Ding,Y.,Somasundaram,S.,Miller,J.A.,Kalmbach,B.E.,Radaelli,C.,etal.(2021).Functionalenhancerelementsdrivesubclass-selectiveexpressionfrommousetoprimateneocortex.CellRep.34,108754.https://doi.org/10.1016/j.celrep.2021.108754.
[70]Li,H.,Namburi,P.,Olson,J.M.,Borio,M.,Lemieux,M.E.,Beyeler,A.,Calhoon,G.G.,Hitora-Imamura,N.,Coley,A.A.,Libster,A.,etal.(2022).Neurotensinorchestratesvalenceassignmentintheamygdala.Nature608,586–592.https://doi.org/10.1038/s41586-022-04964-y.
[71]Ino,D.,Tanaka,Y.,Hibino,H.,andNishiyama,M.(2022).Afluorescentsensorforreal-timemeasurementofextracellularoxytocindynamicsinthebrain.Nat.Methods19,1286–1294.https://doi.org/10.1038/s41592-022-01597-x.
[72]Qian,T.,Wang,H.,Wang,P.,Geng,L.,Mei,L.,Osakada,T.,Wang,L.,Tang,Y.,Kania,A.,Grinevich,V.,etal.(2023).Ageneticallyencodedsensormeasurestemporaloxytocinreleasefromdifferentneuronalcompartments.Nat.Biotechnol.41,944–957.https://doi.org/10.1038/s41587-022-01561-2.
[73]Guo,Z.,Yin,L.,Diaz,V.,Dai,B.,Osakada,T.,Lischinsky,J.E.,Chien,J.,Yamaguchi,T.,Urtecho,A.,Tong,X.,etal.(2023).Neuraldynamicsinthelimbicsystemduringmalesocialbehaviors.Neuron111,3288–3306.e4.https://doi.org/10.1016/j.neuron.2023.07.011.
[74]Chung,J.E.,Sellers,K.K.,Leonard,M.K.,Gwilliams,L.,Xu,D.,Dougherty,M.E.,Kharazia,V.,Metzger,S.L.,Welkenhuysen,M.,Dutta,B.,andChang,E.F.(2022).High-densitysingle-unithumancorticalrecordingsusingtheNeuropixelsprobe.Neuron110,2409–2421.e3.https://doi.org/10.1016/j.neuron.2022.05.007.
[75]Carlson,D.,David,L.K.,Gallagher,N.M.,Vu,M.T.,Shirley,M.,Hultman,R.,Wang,J.,Burrus,C.,McClung,C.A.,Kumar,S.,etal.(2017).DynamicallyTimedStimulationofCorticolimbicCircuitryActivatesaStress-CompensatoryPathway.Biol.Psychiatry82,904–913.https://doi.org/10.1016/j.biopsych.2017.06.008.
[76]Adesnik,H.,andAbdeladim,L.(2021).Probingneuralcodeswithtwo-photonholographicoptogenetics.Nat.Neurosci.24,1356–1366.https://doi.org/10.1038/s41593-021-00902-9.
[77]Nagai,Y.,Miyakawa,N.,Takuwa,H.,Hori,Y.,Oyama,K.,Ji,B.,Takahashi,M.,Huang,X.P.,Slocum,S.T.,DiBerto,J.F.,etal.(2020).Deschloroclozapine,apotentandselectivechemogeneticactuatorenablesrapidneuronalandbehavioralmodulationsinmiceandmonkeys.Nat.Neurosci.23,1157–1167.https://doi.org/10.1038/s41593-020-0661-3.
[78]Challis,R.C.,RavindraKumar,S.,Chan,K.Y.,Challis,C.,Beadle,K.,Jang,M.J.,Kim,H.M.,Rajendran,P.S.,Tompkins,J.D.,Shivkumar,K.,etal.(2019).SystemicAAVvectorsforwidespreadandtargetedgenedeliveryinrodents.Nat.Protoc.14,379–414.https://doi.org/10.1038/s41596-018-0097-3.
[79]Wang,J.B.,Aryal,M.,Zhong,Q.,Vyas,D.B.,andAiran,R.D.(2018).NoninvasiveUltrasonicDrugUncagingMapsWhole-BrainFunctionalNetworks.Neuron100,728–738.e7.https://doi.org/10.1016/j.neuron.2018.10.042.
[80]Shields,B.C.,Kahuno,E.,Kim,C.,Apostolides,P.F.,Brown,J.,Lindo,S.,Mensh,B.D.,Dudman,J.T.,Lavis,L.D.,andTadross,M.R.(2017).Deconstructingbehavioralneuropharmacologywithcellularspecificity.Science356,eaaj2161.https://doi.org/10.1126/science.aaj2161.
[81]Sani,O.G.,Yang,Y.,Lee,M.B.,Dawes,H.E.,Chang,E.F.,andShanechi,M.M.(2018).Moodvariationsdecodedfrommulti-siteintracranialhumanbrainactivity.Nat.Biotechnol.36,954–961.https://doi.org/10.1038/nbt.4200.
[82]Kirkby,L.A.,Luongo,F.J.,Lee,M.B.,Nahum,M.,VanVleet,T.M.,Rao,V.R.,Dawes,H.E.,Chang,E.F.,andSohal,V.S.(2018).AnAmygdala-HippocampusSubnetworkthatEncodesVariationinHumanMood.Cell175,1688–1700.e14.https://doi.org/10.1016/j.cell.2018.10.005.
[83]Jackson,A.D.,Cohen,J.L.,Phensy,A.J.,Chang,E.F.,Dawes,H.E.,andSohal,V.S.(2024).Amygdala-hippocampussomatostatininterneuronbeta-synchronyunderliesacross-speciesbiomarkerofemotionalstate.Neuron112,1182–1195.e5.https://doi.org/10.1016/j.neuron.2023.12.017.
[84]Alagapan,S.,Choi,K.S.,Heisig,S.,Riva-Posse,P.,Crowell,A.,Tiruvadi,V.,Obatusin,M.,Veerakumar,A.,Waters,A.C.,Gross,R.E.,etal.(2023).Cingulatedynamicstrackdepressionrecoverywithdeepbrainstimulation.Nature622,130–138.https://doi.org/10.1038/s41586-023-06541-3.
[85]Maia,T.V.,andFrank,M.J.(2011).Fromreinforcementlearningmodelstopsychiatricandneurologicaldisorders.Nat.Neurosci.14,154–162.https://doi.org/10.1038/nn.2723.
[86]Montague,P.R.,Dolan,R.J.,Friston,K.J.,andDayan,P.(2012).Computationalpsychiatry.TrendsCogn.Sci.16,72–80.https://doi.org/10.1016/j.tics.2011.11.018.
[87]Kishida,K.T.,King-Casas,B.,andMontague,P.R.(2010).Neuroeconomicapproachestomentaldisorders.Neuron67,543–554.https://doi.org/10.1016/j.neuron.2010.07.021.
[88]Bennett,D.,Silverstein,S.M.,andNiv,Y.(2019).TheTwoCulturesofComputationalPsychiatry.JAMAPsychiatry76,563–564.https://doi.org/10.1001/jamapsychiatry.2019.0231.
[89]Huys,Q.J.M.,Maia,T.V.,andFrank,M.J.(2016).Computationalpsychiatryasabridgefromneurosciencetoclinicalapplications.Nat.Neurosci.19,404–413.https://doi.org/10.1038/nn.4238.
[90]Chekroud,A.M.,Zotti,R.J.,Shehzad,Z.,Gueorguieva,R.,Johnson,M.K.,Trivedi,M.H.,Cannon,T.D.,Krystal,J.H.,andCorlett,P.R.(2016).Cross-trialpredictionoftreatmentoutcomeindepression:amachinelearningapproach.LancetPsychiatry3,243–250.https://doi.org/10.1016/s2215-0366(15)00471-x.
[91]Berwian,I.M.,Wenzel,J.G.,Collins,A.G.E.,Seifritz,E.,Stephan,K.E.,Walter,H.,andHuys,Q.J.M.(2020).ComputationalMechanismsofEffortandRewardDecisionsinPatientsWithDepressionandTheirAssociationWithRelapseAfterAntidepressantDiscontinuation.JAMAPsychiatry77,513–522.https://doi.org/10.1001/jamapsychiatry.2019.4971.
[92]Etkin,A.,Patenaude,B.,Song,Y.J.C.,Usherwood,T.,Rekshan,W.,Schatzberg,A.F.,Rush,A.J.,andWilliams,L.M.(2015).Acognitive-emotionalbiomarkerforpredictingremissionwithantidepressantmedications:areportfromtheiSPOT-Dtrial.Neuropsychopharmacology40,1332–1342.https://doi.org/10.1038/npp.2014.333.
[93]Frässle,S.,Marquand,A.F.,Schmaal,L.,Dinga,R.,Veltman,D.J.,vanderWee,N.J.A.,vanTol,M.J.,Schöbi,D.,Penninx,B.W.J.H.,andStephan,K.E.(2020).Predictingindividualclinicaltrajectoriesofdepressionwithgenerativeembedding.NeuroImageClin.26,102213.https://doi.org/10.1016/j.nicl.2020.102213.
[94]Schmaal,L.,Marquand,A.F.,Rhebergen,D.,vanTol,M.J.,Ruhé,H.G.,vanderWee,N.J.A.,Veltman,D.J.,andPenninx,B.W.J.H.(2015).PredictingtheNaturalisticCourseofMajorDepressiveDisorderUsingClinicalandMultimodalNeuroimagingInformation:AMultivariatePatternRecognitionStudy.Biol.Psychiatry78,278–286.https://doi.org/10.1016/j.biopsych.2014.11.018.
[95]Koutsouleris,N.,Kahn,R.S.,Chekroud,A.M.,Leucht,S.,Falkai,P.,Wobrock,T.,Derks,E.M.,Fleischhacker,W.W.,andHasan,A.(2016).Multisitepredictionof4-weekand52-weektreatmentoutcomesinpatientswithfirst-episodepsychosis:amachinelearningapproach.LancetPsychiatry3,935–946.https://doi.org/10.1016/s2215-0366(16)30171-7.
[96]Chekroud,A.M.,Hawrilenko,M.,Loho,H.,Bondar,J.,Gueorguieva,R.,Hasan,A.,Kambeitz,J.,Corlett,P.R.,Koutsouleris,N.,Krumholz,H.M.,etal.(2024).Illusorygeneralizabilityofclinicalpredictionmodels.Science383,164–167.https://doi.org/10.1126/science.adg8538.
[97]Petzschner,F.H.(2024).Practicalchallengesforprecisionmedicine.Science383,149–150.https://doi.org/10.1126/science.adm9218.
[98]Wolfers,T.,Buitelaar,J.K.,Beckmann,C.F.,Franke,B.,andMarquand,A.F.(2015).Fromestimatingactivationlocalitytopredictingdisorder:Areviewofpatternrecognitionforneuroimaging-basedpsychiatricdiagnostics.Neurosci.Biobehav.Rev.57,328–349.https://doi.org/10.1016/j.neubiorev.2015.08.001.
[99]Varoquaux,G.,Raamana,P.R.,Engemann,D.A.,Hoyos-Idrobo,A.,Schwartz,Y.,andThirion,B.(2017).Assessingandtuningbraindecoders:Cross-validation,caveats,andguidelines.Neuroimage145,166–179.https://doi.org/10.1016/j.neuroimage.2016.10.038.
[100]Maia,T.V.,Huys,Q.J.M.,andFrank,M.J.(2017).Theory-BasedComputationalPsychiatry.Biol.Psychiatry82,382–384.https://doi.org/10.1016/j.biopsych.2017.07.016.
[101]Geisler,W.S.,andKersten,D.(2002).Illusions,perceptionandBayes.Nat.Neurosci.5,508–510.https://doi.org/10.1038/nn0602-508.
[102]Petzschner,F.H.,Glasauer,S.,andStephan,K.E.(2015).ABayesianperspectiveonmagnitudeestimation.TrendsCogn.Sci.19,285–293.https://doi.org/10.1016/j.tics.2015.03.002.
[103]Anticevic,A.,Gancsos,M.,Murray,J.D.,Repovs,G.,Driesen,N.R.,Ennis,D.J.,Niciu,M.J.,Morgan,P.T.,Surti,T.S.,Bloch,M.H.,etal.(2012).NMDAreceptorfunctioninlarge-scaleanticorrelatedneuralsystemswithimplicationsforcognitionandschizophrenia.Proc.Natl.Acad.Sci.USA109,16720–16725.https://doi.org/10.1073/pnas.1208494109.
[104]Frank,M.J.,Seeberger,L.C.,andO’Reilly,R.C.(2004).Bycarrotorbystick:cognitivereinforcementlearninginparkinsonism.Science306,1940–1943.https://doi.org/10.1126/science.1102941.
[105]Ratcliff,R.(1978).Atheoryofmemoryretrieval.Psychol.Rev.85,59–108.https://doi.org/10.1037/0033-295X.85.2.59.
[106]Ratcliff,R.(1979).Groupreactiontimedistributionsandananalysisofdistributionstatistics.Psychol.Bull.86,446–461.https://doi.org/10.1037/0033-2909.86.3.446.
[107]Ratcliff,R.(2014).Measuringpsychometricfunctionswiththediffusionmodel.J.Exp.Psychol.Hum.Percept.Perform.40,870–888.https://doi.org/10.1037/a0034954.
[108]Dayan,P.,andNiv,Y.(2008).Reinforcementlearning:thegood,thebadandtheugly.Curr.Opin.Neurobiol.18,185–196.https://doi.org/10.1016/j.conb.2008.08.003.
[109]Sutton,R.S.,andBarto,A.G.(1998).ReinforcementLearning:AnIntroduction(MITPress).
[110]Friston,K.J.,Stephan,K.E.,Montague,R.,andDolan,R.J.(2014).Computationalpsychiatry:thebrainasaphantasticorgan.LancetPsychiatry1,148–158.https://doi.org/10.1016/s2215-0366(14)70275-5.
[111]Petzschner,F.H.,Weber,L.A.E.,Gard,T.,andStephan,K.E.(2017).ComputationalPsychosomaticsandComputationalPsychiatry:TowardaJointFrameworkforDifferentialDiagnosis.Biol.Psychiatry82,421–430.https://doi.org/10.1016/j.biopsych.2017.05.012.
[112]Redish,A.D.,andGordon,J.A.(2016).ComputationalPsychiatry:NewPerspectivesonMentalIllness(TheMITPress)https://doi.org/10.7551/mitpress/9780262035422.001.0001.
[113]Stephan,K.E.,Bach,D.R.,Fletcher,P.C.,Flint,J.,Frank,M.J.,Friston,K.J.,Heinz,A.,Huys,Q.J.M.,Owen,M.J.,Binder,E.B.,etal.(2016).Chartingthelandscapeofpriorityproblemsinpsychiatry,part1:classificationanddiagnosis.LancetPsychiatry3,77–83.https://doi.org/10.1016/s2215-0366(15)00361-2.
[114]Huys,Q.J.M.,Browning,M.,Paulus,M.P.,andFrank,M.J.(2021).Advancesinthecomputationalunderstandingofmentalillness.Neuropsychopharmacology46,3–19.https://doi.org/10.1038/s41386-020-0746-4.
[115]Pedersen,M.L.,Ironside,M.,Amemori,K.I.,McGrath,C.L.,Kang,M.S.,Graybiel,A.M.,Pizzagalli,D.A.,andFrank,M.J.(2021).Computationalphenotypingofbrain-behaviordynamicsunderlyingapproach-avoidanceconflictinmajordepressivedisorder.PLoSComput.Biol.17,e1008955.https://doi.org/10.1371/journal.pcbi.1008955.
[116]Whitton,A.E.,Reinen,J.M.,Slifstein,M.,Ang,Y.S.,McGrath,P.J.,Iosifescu,D.V.,Abi-Dargham,A.,Pizzagalli,D.A.,andSchneier,F.R.(2020).Baselinerewardprocessingandventrostriataldopaminefunctionareassociatedwithpramipexoleresponseindepression.Brain143,701–710.https://doi.org/10.1093/brain/awaa002.
[117]Geana,A.,Barch,D.M.,Gold,J.M.,Carter,C.S.,MacDonald,A.W.,3rd,Ragland,J.D.,Silverstein,S.M.,andFrank,M.J.(2022).UsingComputationalModelingtoCaptureSchizophrenia-SpecificReinforcementLearningDifferencesandTheirImplicationsonPatientClassification.Biol.PsychiatryCogn.Neurosci.Neuroimaging7,1035–1046.https://doi.org/10.1016/j.bpsc.2021.03.017.
[118]Wiecki,T.V.,Poland,J.,andFrank,M.J.(2015).Model-basedcognitiveneuroscienceapproachestocomputationalpsychiatry:Clusteringandclassification.Clin.Psychol.Sci.3,378–399.https://doi.org/10.1177/2167702614565359.
[119]Kang,Y.H.R.,Petzschner,F.H.,Wolpert,D.M.,andShadlen,M.N.(2017).PiercingofConsciousnessasaThreshold-CrossingOperation.Curr.Biol.27,2285–2295.e6.https://doi.org/10.1016/j.cub.2017.06.047.
[120]Mulder,M.J.,vanMaanen,L.,andForstmann,B.U.(2014).Perceptualdecisionneurosciences-amodel-basedreview.Neuroscience277,872–884.https://doi.org/10.1016/j.neuroscience.2014.07.031.
[121]Gold,J.I.,andShadlen,M.N.(2007).Theneuralbasisofdecisionmaking.Annu.Rev.Neurosci.30,535–574.https://doi.org/10.1146/annurev.neuro.29.051605.113038.
[122]Bahl,A.,andEngert,F.(2020).Neuralcircuitsforevidenceaccumulationanddecisionmakinginlarvalzebrafish.Nat.Neurosci.23,94–102.https://doi.org/10.1038/s41593-019-0534-9.
[123]Mathys,C.D.,Lomakina,E.I.,Daunizeau,J.,Iglesias,S.,Brodersen,K.H.,Friston,K.J.,andStephan,K.E.(2014).UncertaintyinperceptionandtheHierarchicalGaussianFilter.Front.Hum.Neurosci.8,825.https://doi.org/10.3389/fnhum.2014.00825.
[124]Collins,A.G.E.,andFrank,M.J.(2014).Opponentactorlearning(OpAL):modelinginteractiveeffectsofstriataldopamineonreinforcementlearningandchoiceincentive.Psychol.Rev.121,337–366.https://doi.org/10.1037/a0037015.
[125]Adams,R.A.,Pinotsis,D.,Tsirlis,K.,Unruh,L.,Mahajan,A.,Horas,A.M.,Convertino,L.,Summerfelt,A.,Sampath,H.,Du,X.M.,etal.(2022).ComputationalModelingofElectroencephalographyandFunctionalMagneticResonanceImagingParadigmsIndicatesaConsistentLossofPyramidalCellSynapticGaininSchizophrenia.Biol.Psychiatry91,202–215.https://doi.org/10.1016/j.biopsych.2021.07.024.
[126]Fradkin,I.,Adams,R.A.,Parr,T.,Roiser,J.P.,andHuppert,J.D.(2020).Searchingforananchorinanunpredictableworld:Acomputationalmodelofobsessivecompulsivedisorder.Psychol.Rev.127,672–699.https://doi.org/10.1037/rev0000188.
[127]Fradkin,I.,Ludwig,C.,Eldar,E.,andHuppert,J.D.(2020).Doubtingwhatyoualreadyknow:Uncertaintyregardingstatetransitionsisassociatedwithobsessivecompulsivesymptoms.PLoSComput.Biol.16,e1007634.https://doi.org/10.1371/journal.pcbi.1007634.
[128]Rigoux,L.,Stephan,K.E.,andPetzschner,F.H.(2024).Beliefs,compulsivebehaviorandreducedconfidenceincontrol.PLoSComput.Biol.20,e1012207.https://doi.org/10.1371/journal.pcbi.1012207.
[129]Adams,R.A.,Stephan,K.E.,Brown,H.R.,Frith,C.D.,andFriston,K.J.(2013).Thecomputationalanatomyofpsychosis.Front.Psychiatry4,47.https://doi.org/10.3389/fpsyt.2013.00047.
[130]Fletcher,P.C.,andFrith,C.D.(2009).Perceivingisbelieving:aBayesianapproachtoexplainingthepositivesymptomsofschizophrenia.Nat.Rev.Neurosci.10,48–58.https://doi.org/10.1038/nrn2536.
[131]Gold,J.M.,Waltz,J.A.,Matveeva,T.M.,Kasanova,Z.,Strauss,G.P.,Herbener,E.S.,Collins,A.G.E.,andFrank,M.J.(2012).Negativesymptomsandthefailuretorepresenttheexpectedrewardvalueofactions:behavioralandcomputationalmodelingevidence.Arch.Gen.Psychiatry69,129–138.https://doi.org/10.1001/archgenpsychiatry.2011.1269.
[132]Krystal,J.H.,Murray,J.D.,Chekroud,A.M.,Corlett,P.R.,Yang,G.,Wang,X.J.,andAnticevic,A.(2017).ComputationalPsychiatryandtheChallengeofSchizophrenia.Schizophr.Bull.43,473–475.https://doi.org/10.1093/schbul/sbx025.
[133]Murray,G.K.,Cheng,F.,Clark,L.,Barnett,J.H.,Blackwell,A.D.,Fletcher,P.C.,Robbins,T.W.,Bullmore,E.T.,andJones,P.B.(2008).Reinforcementandreversallearninginfirst-episodepsychosis.Schizophr.Bull.34,848–855.https://doi.org/10.1093/schbul/sbn078.
[134]Stephan,K.E.,Baldeweg,T.,andFriston,K.J.(2006).Synapticplasticityanddysconnectioninschizophrenia.Biol.Psychiatry59,929–939.https://doi.org/10.1016/j.biopsych.2005.10.005.
[135]Stephan,K.E.,Friston,K.J.,andFrith,C.D.(2009).Dysconnectioninschizophrenia:fromabnormalsynapticplasticitytofailuresofself-monitoring.Schizophr.Bull.35,509–527.https://doi.org/10.1093/schbul/sbn176.
[136]Maia,T.V.,andCano-Colino,M.(2015).Theroleofserotonininorbitofrontalfunctionandobsessive-compulsivedisorder.Clin.Psychol.Sci.3,460–482.https://doi.org/10.1177/2167702614566809.
[137]Gillan,C.M.,Papmeyer,M.,Morein-Zamir,S.,Sahakian,B.J.,Fineberg,N.A.,Robbins,T.W.,anddeWit,S.(2011).Disruptioninthebalancebetweengoal-directedbehaviorandhabitlearninginobsessive-compulsivedisorder.Am.J.Psychiatry168,718–726.https://doi.org/10.1176/appi.ajp.2011.10071062.
[138]Gillan,C.M.,Robbins,T.W.,Sahakian,B.J.,vandenHeuvel,O.A.,andvanWingen,G.(2016).Theroleofhabitincompulsivity.Eur.Neuropsychopharmacol.26,828–840.https://doi.org/10.1016/j.euroneuro.2015.12.033.
[139]Pike,A.C.,andRobinson,O.J.(2022).ReinforcementLearninginPatientsWithMoodandAnxietyDisordersvsControlIndividuals:ASystematicReviewandMeta-analysis.JAMAPsychiatry79,313–322.https://doi.org/10.1001/jamapsychiatry.2022.0051.
[140]Vandendriessche,H.,Demmou,A.,Bavard,S.,Yadak,J.,Lemogne,C.,Mauras,T.,andPalminteri,S.(2023).Contextualinfluenceofreinforcementlearningperformanceofdepression:evidenceforanegativitybias?Psychol.Med.53,4696–4706.https://doi.org/10.1017/s0033291722001593.
[141]Ahmed,S.H.,andKoob,G.F.(2005).Transitiontodrugaddiction:anegativereinforcementmodelbasedonanallostaticdecreaseinrewardfunction.Psychopharmacol.(Berl.)180,473–490.https://doi.org/10.1007/s00213-005-2180-z.
[142]Dezfouli,A.,Piray,P.,Keramati,M.M.,Ekhtiari,H.,Lucas,C.,andMokri,A.(2009).Aneurocomputationalmodelforcocaineaddiction.NeuralComput.21,2869–2893.https://doi.org/10.1162/neco.2009.10-08-882.
[143]Everitt,B.J.,andRobbins,T.W.(2005).Neuralsystemsofreinforcementfordrugaddiction:fromactionstohabitstocompulsion.Nat.Neurosci.8,1481–1489.https://doi.org/10.1038/nn1579.
[144]Redish,A.D.(2004).Addictionasacomputationalprocessgoneawry.Science306,1944–1947.https://doi.org/10.1126/science.1102384.
[145]Redish,A.D.,Jensen,S.,andJohnson,A.(2008).Aunifiedframeworkforaddiction:vulnerabilitiesinthedecisionprocess.Behav.BrainSci.31,415–437.https://doi.org/10.1017/s0140525x0800472x.
[146]Brodersen,K.H.,Deserno,L.,Schlagenhauf,F.,Lin,Z.,Penny,W.D.,Buhmann,J.M.,andStephan,K.E.(2014).Dissectingpsychiatricspectrumdisordersbygenerativeembedding.NeuroImageClin.4,98–111.https://doi.org/10.1016/j.nicl.2013.11.002.
[147]Galioulline,H.,Frässle,S.,Harrison,S.J.,Pereira,I.,Heinzle,J.,andStephan,K.E.(2023).Predictingfuturedepressiveepisodesfromresting-statefMRIwithgenerativeembedding.Neuroimage273,119986.https://doi.org/10.1016/j.neuroimage.2023.119986.
[148]Wiecki,T.V.,Antoniades,C.A.,Stevenson,A.,Kennard,C.,Borowsky,B.,Owen,G.,Leavitt,B.,Roos,R.,Durr,A.,Tabrizi,S.J.,andFrank,M.J.(2016).AComputationalCognitiveBiomarkerforEarly-StageHuntington’sDisease.PLoSOne11,e0148409.https://doi.org/10.1371/journal.pone.0148409.
[149]Gillan,C.M.,andRutledge,R.B.(2021).SmartphonesandtheNeuroscienceofMentalHealth.Annu.Rev.Neurosci.44,129–151.https://doi.org/10.1146/annurev-neuro-101220-014053.
[150]Gunsilius,C.Z.,Heffner,J.,Bruinsma,S.,Corinha,M.,Cortinez,M.,Dalton,H.,Duong,E.,Lu,J.,Omar,A.,Owen,L.L.W.,etal.(2024).SOMAScience:ANovelPlatformforMultidimensional,LongitudinalPainAssessment.JMIRMHealthUHealth12,e47177.https://doi.org/10.2196/47177.
[151]Eldar,E.,Roth,C.,Dayan,P.,andDolan,R.J.(2018).DecodabilityofRewardLearningSignalsPredictsMoodFluctuations.Curr.Biol.28,1433–1439.e7.https://doi.org/10.1016/j.cub.2018.03.038.
[152]Fu,Z.,Liu,J.,Salman,M.S.,Sui,J.,andCalhoun,V.D.(2023).Functionalconnectivityuniquenessandvariability?Linkageswithcognitiveandpsychiatricproblemsinchildren.Nat.MentalHealth1,956–970.https://doi.org/10.1038/s44220-023-00151-8.
[153]Volkow,N.D.,Koob,G.F.,Croyle,R.T.,Bianchi,D.W.,Gordon,J.A.,Koroshetz,W.J.,Pérez-Stable,E.J.,Riley,W.T.,Bloch,M.H.,Conway,K.,etal.(2018).TheconceptionoftheABCDstudy:FromsubstanceusetoabroadNIHcollaboration.Dev.Cogn.Neurosci.32,4–7.https://doi.org/10.1016/j.dcn.2017.10.002.
[154]Bianchi,D.W.,Brennan,P.F.,Chiang,M.F.,Criswell,L.A.,D’Souza,R.N.,Gibbons,G.H.,Gilman,J.K.,Gordon,J.A.,Green,E.D.,Gregurick,S.,etal.(2024).TheAllofUsResearchProgramisanopportunitytoenhancethediversityofUSbiomedicalresearch.Nat.Med.30,330–333.https://doi.org/10.1038/s41591-023-02744-3.
[155]Wilkinson,M.D.,Dumontier,M.,Aalbersberg,I.J.J.,Appleton,G.,Axton,M.,Baak,A.,Blomberg,N.,Boiten,J.W.,daSilvaSantos,L.B.,Bourne,P.E.,etal.(2016).TheFAIRGuidingPrinciplesforscientificdatamanagementandstewardship.Sci.Data3,160018.https://doi.org/10.1038/sdata.2016.18.
[156]Wilson,R.C.,andCollins,A.G.(2019).Tensimplerulesforthecomputationalmodelingofbehavioraldata.eLife8,e49547.https://doi.org/10.7554/eLife.49547.
[157]Daunizeau,J.,Adam,V.,andRigoux,L.(2014).VBA:aprobabilistictreatmentofnonlinearmodelsforneurobiologicalandbehaviouraldata.PLoSComput.Biol.10,e1003441.https://doi.org/10.1371/journal.pcbi.1003441.
[158]Fengler,A.,Govindarajan,L.N.,Chen,T.,andFrank,M.J.(2021).Likelihoodapproximationnetworks(LANs)forfastinferenceofsimulationmodelsincognitiveneuroscience.eLife10,e65074.https://doi.org/10.7554/eLife.65074.
[159]Frässle,S.,Aponte,E.A.,Bollmann,S.,Brodersen,K.H.,Do,C.T.,Harrison,O.K.,Harrison,S.J.,Heinzle,J.,Iglesias,S.,Kasper,L.,etal.(2021).TAPAS:AnOpen-SourceSoftwarePackageforTranslationalNeuromodelingandComputationalPsychiatry.Front.Psychiatry12,680811.https://doi.org/10.3389/fpsyt.2021.680811.
[160]Rutherford,S.,Kia,S.M.,Wolfers,T.,Fraza,C.,Zabihi,M.,Dinga,R.,Berthet,P.,Worker,A.,Verdi,S.,Ruhe,H.G.,etal.(2022).Thenormativemodelingframeworkforcomputationalpsychiatry.Nat.Protoc.17,1711–1734.https://doi.org/10.1038/s41596-022-00696-5.
[161]Wiecki,T.V.,Sofer,I.,andFrank,M.J.(2013).HDDM:HierarchicalBayesianestimationoftheDrift-DiffusionModelinPython.Front.Neuroinform.7,14.https://doi.org/10.3389/fninf.2013.00014.
[162]Khalsa,S.S.,Adolphs,R.,Cameron,O.G.,Critchley,H.D.,Davenport,P.W.,Feinstein,J.S.,Feusner,J.D.,Garfinkel,S.N.,Lane,R.D.,Mehling,W.E.,etal.(2018).InteroceptionandMentalHealth:ARoadmap.Biol.PsychiatryCogn.Neurosci.Neuroimaging3,501–513.https://doi.org/10.1016/j.bpsc.2017.12.004.
[163]Petzschner,F.H.,Garfinkel,S.N.,Paulus,M.P.,Koch,C.,andKhalsa,S.S.(2021).ComputationalModelsofInteroceptionandBodyRegulation.TrendsNeurosci.44,63–76.https://doi.org/10.1016/j.tins.2020.09.012.
[164]Edwards,M.J.,Adams,R.A.,Brown,H.,Pareés,I.,andFriston,K.J.(2012).ABayesianaccountof’hysteria’.Brain135,3495–3512.https://doi.org/10.1093/brain/aws129.
[165]Löffler,M.,Levine,S.M.,Usai,K.,Desch,S.,Kandic,M.,Nees,F.,andFlor,H.(2022).Corticostriatalcircuitsinthetransitiontochronicbackpain:Thepredictiveroleofrewardlearning.CellRep.Med.3,100677.https://doi.org/10.1016/j.xcrm.2022.100677.
[166]Mansour,A.R.,Farmer,M.A.,Baliki,M.N.,andApkarian,A.V.(2014).Chronicpain:theroleoflearningandbrainplasticity.Restor.Neurol.Neurosci.32,129–139.https://doi.org/10.3233/rnn-139003.
[167]Stephan,K.E.,Manjaly,Z.M.,Mathys,C.D.,Weber,L.A.E.,Paliwal,S.,Gard,T.,Tittgemeyer,M.,Fleming,S.M.,Haker,H.,Seth,A.K.,andPetzschner,F.H.(2016).AllostaticSelf-efficacy:AMetacognitiveTheoryofDyshomeostasis-InducedFatigueandDepression.Front.Hum.Neurosci.10,550.https://doi.org/10.3389/fnhum.2016.00550.
[168]Rouault,M.,Pereira,I.,Galioulline,H.,Fleming,S.M.,Stephan,K.E.,andManjaly,Z.M.(2023).Interoceptiveandmetacognitivefacetsoffatigueinmultiplesclerosis.Eur.J.Neurosci.58,2603–2622.https://doi.org/10.1111/ejn.16048.
[169]Cioffi,V.,Mosca,L.L.,Moretto,E.,Ragozzino,O.,Stanzione,R.,Bottone,M.,Maldonato,N.M.,Muzii,B.,andSperandeo,R.(2022).ComputationalMethodsinPsychotherapy:AScopingReview.Int.J.Environ.Res.PublicHealth19,12358.https://doi.org/10.3390/ijerph191912358.
[170]Deisenhofer,A.K.,Barkham,M.,Beierl,E.T.,Schwartz,B.,Aafjes-vanDoorn,K.,Beevers,C.G.,Berwian,I.M.,Blackwell,S.E.,Bockting,C.L.,Brakemeier,E.L.,etal.(2024).Implementingprecisionmethodsinpersonalizingpsychologicaltherapies:Barriersandpossiblewaysforward.Behav.Res.Ther.172,104443.https://doi.org/10.1016/j.brat.2023.104443.
[171]Moutoussis色站,M.,Shahar,N.,Hauser,T.U.,andDolan,R.J.(2018).ComputationinPsychotherapy,orHowComputationalPsychiatryCanAidLearning-BasedPsychologicalTherapies.Comput.Psychiatr.2,50–73.https://doi.org/10.1162/CPSY_a_00014.





